《中国肿瘤临床》公众号
综述
急性髓系白血病的免疫治疗研究进展
李甜甜, 孔繁聪
(南昌大学江西医学院第一附属医院)
摘要
急性髓系白血病(acute myeloid leukemia,AML)是一种血液系统恶性肿瘤。数十年来,化疗仍然是AML的主要治疗手段。近年来随着靶向药物的应用,AML的治疗发生了改变。然而,仍有部分患者对治疗耐药或在治疗后复发。因此,需积极探索新型高效低毒的方案以进一步改善患者的临床结局。免疫治疗是通过调节机体免疫反应而达到抗肿瘤治疗目的的疗法,其在复发/难治性患者中展现出可观的疗效及可控的安全性,有望成为该类患者的重要治疗选择。本文就免疫治疗在AML中的研究进展进行综述。
前言
急性髓系白血病(acute myeloid leukemia,AML)是一种血液系统恶性肿瘤,化疗、靶向治疗和异基因造血干细胞移植(allogeneic hematopoietic stem cell transplantation,Allo-HSCT)是其主要治疗手段,标准化疗在AML患者中的5年总生存(overall survival,OS)率≤35%,7天阿糖胞苷+3天柔红霉素治疗(7+3方案)联合米哚妥林使AML患者的4年OS率达到51%,阿糖胞苷柔红霉素脂质体联合Allo-HSCT治疗高危AML患者的OS率达到58%[1]。然而化疗无效或复发的患者5年OS率<40%[2]。因此,需积极探索新型治疗手段以改善AML患者预后。
免疫治疗通过调节免疫反应治疗原发病,主要包括免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)、抗体、嵌合抗原受体(chimeric antigen receptors,CAR)疗法和疫苗,在淋巴细胞恶性肿瘤中的研究已相当成熟。吉妥珠单抗奥佐米星(gemtuzumab ozogamicin,GO)于2000年首次获得美国食品药品监督管理局(FDA)批准,治疗不适合强化疗(unfit)AML患者,随后免疫治疗在复发/难治性(relapsed/refractory,R/R)AML中的研究相继开展。AML相关特异性抗原的发现拓展了免疫治疗的靶点。以抗体为基础的抗体-药物偶联物(antibody drug conjugate,ADC)和双特异性抗体(bispecific monoclonal antibody,BsAb)增强临床疗效的同时减少了治疗相关不良反应。免疫治疗与其他治疗的联合应用也在逐步探索中。本文对AML中的主要免疫治疗进行综述。
01
免疫检查点抑制剂
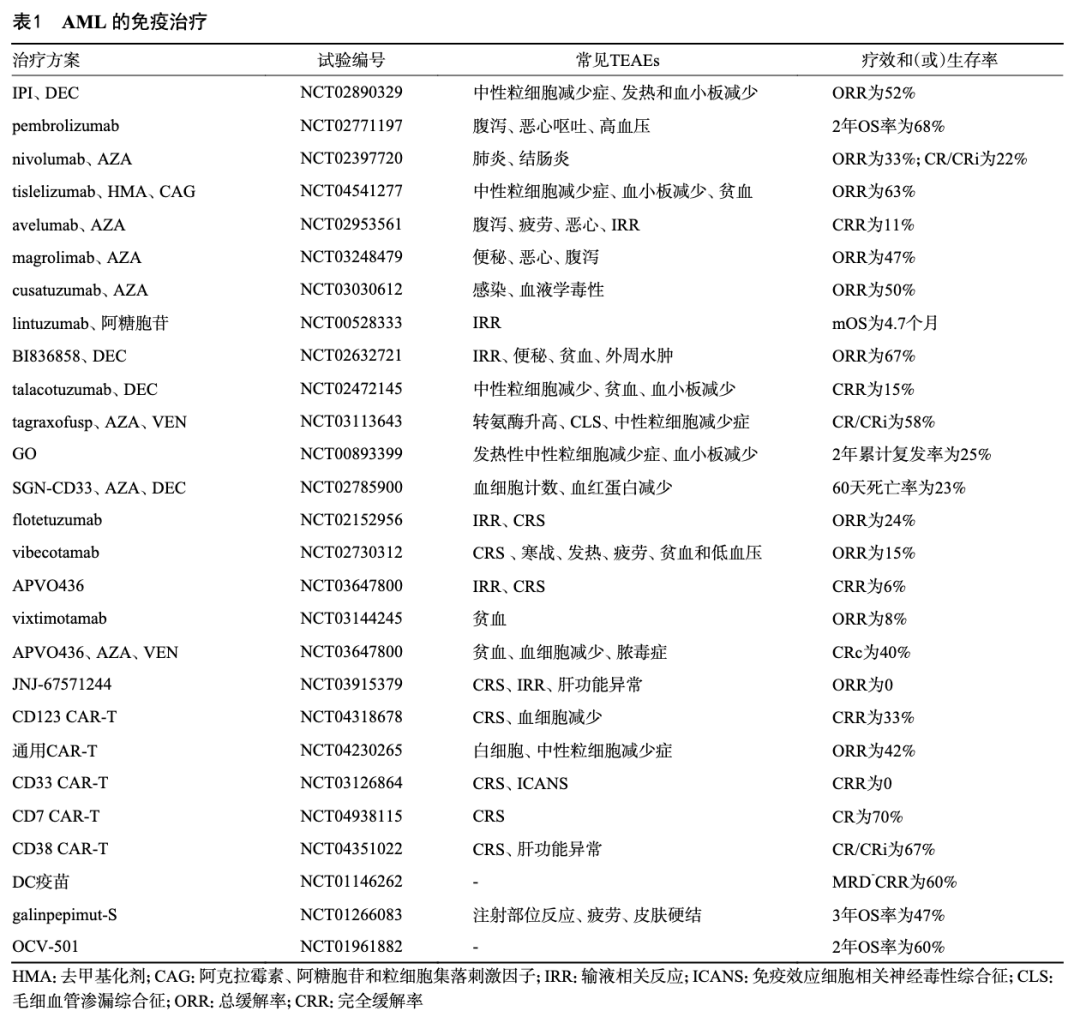
参与抗原呈递和共刺激过程的抑制性免疫检查点在抗原呈递细胞和AML细胞中过表达,阻碍抗AML免疫的产生。这些检查点包括程序性死亡受体-1(programmed death receptor-1,PD-1)、程序性死亡配体1(programmed death-ligand 1,PD-L1)、细胞毒性T淋巴细胞抗原4(cytotoxic T lymphocyte-associate protein-4,CTLA-4)、T淋巴细胞免疫球蛋白和黏蛋白结构域3(T cell immunoglobulin domain and mucin domain-3,TIM-3)、CD47和CD70等。靶向抑制性免疫检查点能够恢复抗AML免疫应答[3]。目前,已经进行多项ICI相关临床试验,见表1和表2。
1.1 CTLA-4
伊匹木单抗(ipilimumab,IPI)是一种针对CTLA-4的ICI,通过阻断CTLA-4恢复T细胞抗AML免疫[3]。Garcia等[4]证实了10 mg/m2的IPI在Allo-HSCT后复发患者中的抗AML活性,该研究将IPI联合地西他滨(decitabine,DEC)方案应用于未移植或Allo-HSCT后的AML及骨髓增生异常综合征(myelodysplastic syndromes,MDS)患者,未移植患者的总缓解率(overall response rate,ORR)明显高于Allo-HSCT患者(52% vs. 20%,P=0.034)。≥3级治疗相关不良事件(treatment emergent adverse event,TEAE)的发生率为28%~61%,免疫相关不良事件(immune-related adverse event,irAE)的发生率随剂量水平而升高。提示在Allo-HSCT前给予IPI联合DEC方案可能为AML患者带来生存获益,治疗过程中需关注不良反应。

1.2 PD-1/PD-L1
PD-1在T细胞上过表达,PD-1/PD-L1相互作用参与AML细胞免疫逃逸[3]。PD-1单抗在实体瘤中具有积极疗效,在AML中亦有应用。PD-L1单抗相关临床试验在国外已有开展。
帕博利珠单抗(pembrolizumab)、纳武利尤单抗(nivolumab)和替雷利珠单抗(tislelizumab)是AML临床试验中使用最多的PD-1单抗。Pembroluzimab在新诊断(new diagnosed,ND)AML中的CR/ CRi达到47%,pembrolizumab、nivolumab分别联合阿扎胞苷(azacitidine,AZA)治疗R/R AML的完全缓解(complete response,CR)/完全缓解伴不完全血液学恢复(CR with incomplete blood count recovery,CRi)率为14%~22%,中位总生存(media OS,mOS)为6.3~10.8个月,≥3级irAE的发生率≤24%[5-6]。Allo-HSCT后复发的AML患者经tislelizumab联合AZA方案治疗获得CR的病例也有报道[7]。为改善R/R AML患者的生存,Zeidner等[8]研究发现pembrolizumab联合大剂量阿糖胞苷的复合完全缓解(composite complete response,CRc)为38%。近期Ⅱ期试验(NCT02771197、NCT02981914)显示,pembrolizumab的应用使得自体HSCT后复发的AML患者的生存率(45% vs. 14%)提高,Allo-HSCT后复发的恶性血液肿瘤患者的无复发生存期(relapse-free survival,RFS)达到364天。Nivolumab-伊达比星-阿糖胞苷方案衔接Allo-HSCT在ND AML/MDS中的ORR达80%[9]。Tislelizumab相关联合用药方案在R/R AML中的ORR达63%[10]。上述成果激发了研究者对PD-1单抗联合用药的兴趣。
临床研究中常用的PD-L1单抗包括阿维鲁单抗(avelumab)、阿替利珠单抗(atezolizumab)和度伐利尤单抗(durvalumab)。Ⅰ期试验显示avelumab增强了细胞毒性T淋巴细胞的毒性,这可能与irAE的发生有关[11]。Avelumab(≤10 mg/kg)联合AZA治疗R/R AML的完全缓解率(complete response rate,CRR)仅为10.5%,mOS为4.8个月[12]。Atezolizumab联合玛格利单抗(magrolimab)(NCT03922477)以及durvalumab联合AZA在AML中的疗效均不理想[13]。
1.3 其他ICIs
TIM-3降低免疫细胞抗AML活性,CD47则抑制巨噬细胞对AML细胞的吞噬,肿瘤坏死因子CD70促进白血病干细胞(leukemia stem cells,LSCs)增殖[3]。Ⅰb期试验[14]显示TIM-3单抗sabatolimab联合DEC方案治疗ND和R/R AML患者的CR/CRi率均为29%。CD47单抗magrolimab联合AZA治疗TP53突变(TP53 mutation,TP53m)ND AML患者的ORR为47.2%,mOS为9.8个月[15]。后续Ⅲ期ENHANCE-2试验[16]显示magrolimab联合AZA方案治疗ND TP53mAML的缓解率及生存期较阿扎胞苷、维奈克拉(AZA+VEN)方案或7+3方案差。CD70单抗cusatuzumab联合AZA治疗ND unfit AML的ORR为50%,mOS为11.5个月[17]。
02
抗体
多种抗原在AML细胞表面高表达,是AML的良好靶点。单克隆抗体引起多种抗AML免疫反应[18]。ADC由抗体和细胞毒性药物组成,BsAb能够活化T细胞,两者对AML细胞具有优越的杀伤作用。抗体相关临床试验,见表1和表2。
2.1 CD33
林妥珠单抗(lintuzumab)是一种CD33单抗,与米托蒽醌-依托泊苷-阿糖胞苷方案或低剂量阿糖胞苷相比,lintuzumab联合上述药物未能改善ND和R/R AML患者的CRR及OS[19-20]。新型CD33单抗BI836858(80 mg)联合DEC方案在unfit AML中的ORR达66.7%,值得进一步临床研究[21]。
GO是由卡奇霉素与CD33抗体组成的CD33 ADC,最初被FDA批准用于CD33+AML患者,2013年因其联合7+3方案无确凿疗效证据而退出临床。然而ALFA-0701及MyloFrance-1研究提示分次GO联合标准化疗可改善患者的RFS和OS,FDA由此重新批准GO在CD33+ND AML中的应用[18]。新型CD33 ADC即SGN-CD33,联合AZA或DEC方案治疗CD33+AML的CR/CRi达70%[22],但临床试验(NCT02785900)显示该方案在2个月内的死亡率迅速增加。
维克替莫单抗(vixtimotamab)、AMG330和JNJ-67571244是3种CD33 BsAb,vixtimotamab在Ⅰ期试验(NCT03144245)中未报告剂量限制毒性,Ⅰ期试验(NCT02520427、NCT03915379)显示AMG330相关细胞因子释放综合征(cytokine release syndrome,CRS)达67%,JNJ-67571244相关TEAE率为100%。然而双靶点CD33/CD123纳米T细胞接合器能够通过杀伤CD123+和(或)CD33+AML细胞降低CD123-或CD33-AML细胞所引起的复发风险,且未有发生CRS的迹象,这为CD33 BsAb带来新的希望[23]。
2.2 CD123
CD123在AML细胞和LSCs上广泛表达。塔妥珠单抗(talacotuzumab)通过阻断CD123来增强自然杀伤(natural killer,NK)细胞介导的AML细胞凋亡[24]。推荐剂量(9 mg/kg)的talacotuzumab联合DEC治疗unfit AML相比于DEC单药在CRR和mOS上无显著改善,后续研究遂终止[24]。
塔格拉索夫(tagraxofusp)和匹维奇单抗(IMGN632)是两种CD123 ADC。Tagraxofusp在CD123+AML中活性明显[25]。Tagraxofusp联合AZA+VEN方案在ND AML患者中的CR/CRi率为58%,形态学无白血病状态(morphologic leukemia-free state,MLFS)比例为12%,在TP53m患者的CR/CRi/MLFS率达54%[25]。推荐剂量(0.045 mg/kg)的IMGN632治疗R/R AML的CR/CRi/MLFS为32%[26]。IMGN632联合AZA+VEN方案治疗ND AML的CRc为66%,但≥3级发热性中性粒细胞减少症的发生率达44%[27]。
伏妥珠单抗(flotetuzumab)、维贝妥单抗(vibecotamab)和APVO436是常用于R/R AML的CD123 BsAb。Flotetuzumab(500 ng/kg/d)治疗R/R AML/MDS的ORR为24%[28]。Vibecotamab(≥0.75 μg/kg)在R/R AML中的ORR仅为15%[29]。APVO436在Ⅰb期试验(NCT03647800)中的CRR仅为5.8%。0.2 μg/kg的APVO436联合AZA+VEN的CRc达到了40%,值得进一步临床研究[30]。
2.3 CLL-1和FLT3
C型凝集素样分子1(C-type lectin-like molecule-1,CLL-1)在LSCs和AML细胞上高表达。DCLL9718S作为CLL-1 ADC,在R/R AML患者中缓解率为0,≥3级AE发生率达67%[31]。Fms样酪氨酸激酶3(fms like tyrosine kinase 3,FLT3)基因突变在AML中发挥重要作用,FLT3 ADC与米哚妥林具有协同抗AML作用[32]。AMG427和CLN-049是两种FLT3 BsAb,在R/R AML中的Ⅰ期试验(NCT03541369、NCT05143996)结果待公布。
03
CAR疗法
CAR细胞表达靶抗原受体,CAR结合AML细胞表面抗原,引起T细胞、NK细胞对AML细胞的持续性杀伤。CD123、CD33、CLL-1、CD7和CD38均高表达于AML细胞,是AML中常用的CAR靶点。其中,CD33和CLL-1在LSCs亦有表达,能够诱导对LSCs的杀伤。CD33和CD123在正常造血干/祖细胞、髓系细胞和其他细胞上表达,导致CD33或CD123 CAR发生脱靶效应的几率增加[33]。已经完成和正在进行的CAR相关临床试验,见表1和表2。
3.1 CAR-T
CD123 Ⅰ期试验显示,1×106/kg剂量组的自体CD123 CAR-T细胞成功在3例R/R AML患者体内扩增,CR/CRi为33.3%[33]。通用CAR-T在剂量递增研究中的ORR为50%,TEAE多轻微[34]。目前,Ⅰ期试验NCT03766126正在评估慢病毒转导的CD123 CAR-T在R/R AML中的疗效。
CD33早期1例R/R AML患者经CD33 CAR-T治疗后骨髓原始细胞比例由50%降至6%,频繁发热、输血依赖等问题明显[33]。Ⅰ期临床试验显示,30%(3/10)R/R AML患者成功接受自体CD33 CAR-T细胞治疗,缓解率为0,出现了多种TEAEs[33]。然而具有两种共刺激分子的新一代CD33 CAR-T展现出优越的扩增能力和持久性[35],激发了研究者对CD33 CAR-T的浓厚兴趣。
CD7 约30%的AML细胞表达CD7。最初,1例R/R AML患者接受自体CD7 CAR-T治疗后达到MLFS[36]。10例国内患者经序贯CD7 CAR-T衔接Allo-HSCT治疗后的CRc为60%,4级全血细胞减少的发生率为100%[37]。然而Lu等[38]制备出的基于重链抗体的CD7 CAR-T在CD7+AML患者中的TEAEs轻微,CRR达70%。国外研究还发现CD7蛋白质阻滞剂以及经CRISPR-Cas9技术敲除CD7基因有助于避免CD7 CAR-T因细胞间相互作用而耗竭[39]。目前,CD7 CAR-T正在进一步临床研究中。
CLL-1和CD38 移植后复发的AML患者在CLL-1 CAR-T联合PD-1敲除治疗后缓解的案例早有报道[33]。CLL-1 CAR-T治疗R/R AML的CR/CRi为70%,488天OS率为60%,但CRS和重度全血细胞减少的发生率达100%[40]。异体来源CD38 CAR-T治疗4周的CR/CRi率也达到66.7%, mOS为7.9个月,其TEAE多为短暂可控的≤3级CRS及肝毒性[41]。
3.2 CAR-NK
CD33 CAR-NK在首次临床试验中导致的CRS普遍轻微,治疗28天时微小残留病灶(minimal residual disease,MRD)阴性CRR达60%(6/10)[42]。Garcia等[43]还报道称CD38 CAR-NK表达的CD38部分替代了CD226在NK细胞介导的抗AML反应中的作用。IL-15的表达对CAR-NK的持久性也至关重要[44]。目前,多项CAR-NK相关试验正在进行。
04
疫苗
肿瘤衍生疫苗能够降低AML负荷。AML中常用的疫苗包括树突状细胞(dendritic cell,DC)疫苗和蛋白质/肽疫苗,后者又以肾母细胞瘤蛋白1(Wilms tumor protein1,WT1)疫苗研究最广。疫苗在AML中应用的临床试验已于表1、表2中列出。
4.1 树突状细胞疫苗
DC疫苗通过表达肿瘤相关抗原引起抗AML免疫反应。自体DC疫苗治疗老年AML的60天MRD阴性CRR为60%(3/5),mOS显著长于未接种者(509天 vs. 147.5天,P=0.03)[45]。异体DC疫苗治疗后缓解的AML/MDS患者生存期(1090天 vs. 144天,P=0.03)显著延长[46]。表达WT1和黑色素瘤特异性抗原的新型DC疫苗在不适合Allo-HSCT的CR期AML患者中的CRR为55%,5年OS率达75%[47]。目前,DC疫苗相关研究备受关注。
4.2 WT1疫苗
WT1在AML细胞上的过表达促成了WT1疫苗的多项临床试验。其中galinpepimut-S治疗的3年OS率为47%,复发率高达68%[48]。Galinpepimut-S联合pembrolizumab方案的临床研究(NCT03761914)因缺乏疗效而终止。OCV-501治疗的2年无病生存率(40.9% vs. 41.4%,P=0.77)和OS率(60.3% vs. 58.5%,P=0.85)相比安慰剂组无明显改善[49]。但正在进行的新型WT1肽疫苗DSP-7888相关临床试验NCT04747002仍然值得关注。
05
结语
在早期临床试验中,部分AML免疫治疗疗效有限,长期生存率低,不良反应严重。基于此,科研人员尝试挖掘可用靶点以及非单一靶点抗体/CAR疗法。此外,免疫治疗与化疗、靶向治疗、HSCT的联合应用为AML的研究热点,相信在不久的将来,免疫治疗能够克服疗效和不良反应问题,在AML的治疗中发挥重要作用。
End
引用本文:
李甜甜, 孔繁聪. 急性髓系白血病的免疫治疗研究进展[J]. 中国肿瘤临床, 2025, 52(7): 354-360. DOI: 10.12354/j.issn.1000-8179.2025.20250399
版权声明:
本文为《中国肿瘤临床》原创文章,其他媒体、网站、公众号等如需转载本文,请在本文留言中获得授权,并在转载文章开头显示注明“原文刊发于《中国肿瘤临床》,卷(期):起止页码”。谢谢合作!
封面图片来源:pexels. 作者:Marta Branco.