引言

研究结果显示,以西达基奥仑赛为代表的 CAR-T 细胞疗法在三重难治 MM 患者(对至少一种蛋白酶抑制剂、免疫调节剂、CD38 单抗难治)带来了 70% 以上的缓解率 [5]。
来自 EBMT 统计的数据显示,EMD 的发病率由 2025 年的 6.5% 稳步上升至 2014 年的 23.7%,这一上升趋势很有可能归因于新疗法的问世显著延长了 MM 患者的生存期,同时显著增加了髓外浸润的可能性 [6]。
值得注意的是,现有文献对于 EMD 的定义尚未统一。有些文献中,EMD 是指 MM 患者合并的浆细胞瘤,包括与骨相邻的病变(骨旁病变)和与骨完全分离的病变;而有些文献中,EMD 则仅指与骨完全分离的病变。笔者与该研究的作者一致认为,只有与骨分离的浆细胞瘤才是真正的 EMD,并将与骨相邻的浆细胞瘤称为 PSD [7]。
尽管 EMD 和 PSD 都会影响 MM 患者的预后,但多项研究发现,合并 PSD 和 EMD 的患者的临床结局存在差异,其中合并 EMD 的患者预后最差 [8]。Pour 等指出,仅骨髓复发的骨髓瘤患者的中位总生存期(OS)为 109 个月,而合并 PSD 和 EMD 患者的中位总生存期(OS)分别为 45 个月和 30 个月 [9]。大多数已发表的关于 CAR-T 治疗的数据报道,软组织浆细胞瘤患者的预后确实更差,但没有区分合并 EMD 和 PSD 患者的情况 [10]。
鉴于在 CAR-T 细胞输注后,患者体内骨髓通常为 MRD 持续阴性,以及 PSD 的生物学来源通常与骨髓有关,因此,研究者假设,与 CAR-T 细胞治疗相关的不良预后主要与 EDM 相关,而非 PSD [11]。基于此,研究者开展了一项试验,旨在评估 EMD、PSD 与 CAR-T 细胞治疗后临床结局的相关性,并尝试描述合并 EMD 的 RRMM 患者预后的相关临床及病理学特征。
研究者针对 2017 年 1 月至 2023 年 3 月在美国西奈山医院接受 CAR-T 细胞治疗的 RRMM 患者进行了回顾性分析,并收集了基线人口统计数据、CAR-T 细胞疗法类型和 CAR-T 细胞治疗后的临床结局。其中,收集的数据涵盖详细的疾病特征,包括是否合并 EMD、PSD、位置和病灶体积。缓解率根据国际骨髓瘤工作组(IMWG)共识标准 [12] 进行评估。
根据 CAR-T 细胞治疗前最近一次扫描结果显示是否合并 EMD 和 PSD,将患者分为三组:基线状态下,合并 EMD 患者为髓外浸润组(EMD+),有 PSD 但无 EMD 的患者为骨旁浸润组(PSD-only),无 EMD 和 PSD 的患者为无髓外浸润组(BM-only),同时合并 EMD 和 PSD 的患者被纳入髓外浸润组。EMD + 组的患者髓外病灶的负荷采用标准 IMWG 方法进行评估,取每个髓外病灶最大垂直径乘积之和(SPD)。此外,根据 EMD 的发生部位对患者进行分类,将淋巴结、皮下、肌内、胸膜病变视为软组织病变,将肾脏、肝脏、中枢神经系统病变视为器官病变。
生存结局的评估方面,无进展生存期(PFS)和总生存期(OS)均为从 CAR-T 细胞输注时开始计算,并使用 Kaplan-Meier(KM)评估和 log-rank 检验来比较「EMD+」、「PSD-only」和「BM-only」组之间的曲线。采用反向 Kaplan-Meier 法(Reverse KM)估计中位随访时间,使用 Cox 比例风险模型评估风险比和相应的 95% 可信区间(CI)。
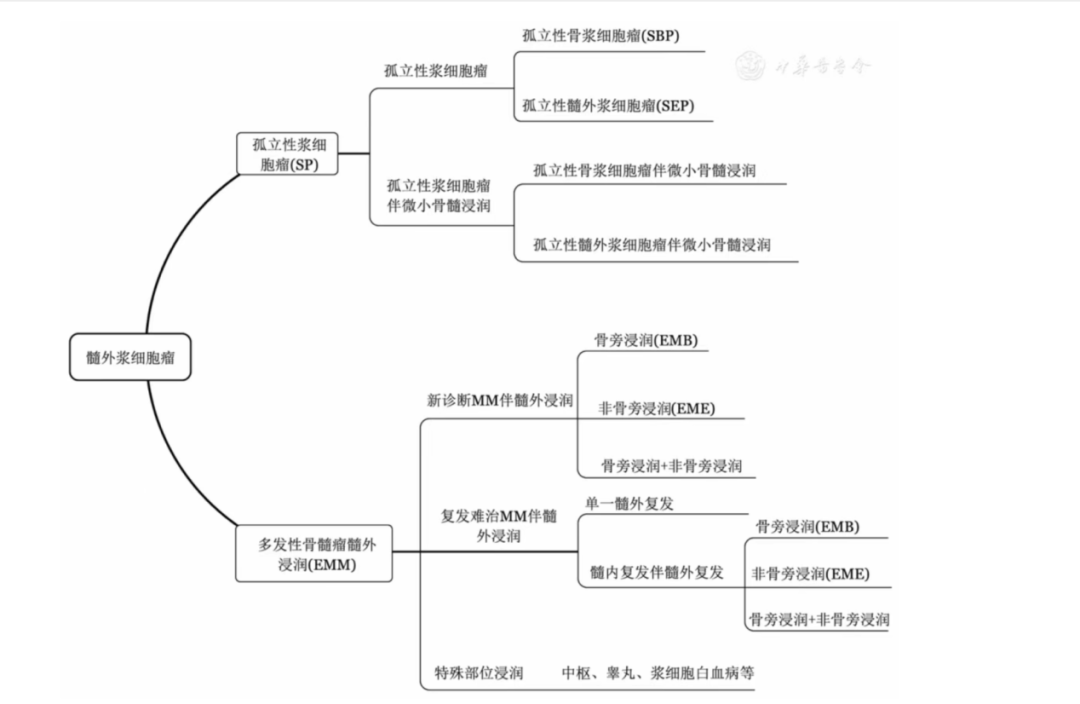
在试验期间,共有 134 例 RRMM 患者接受了 CAR-T 细胞治疗并被纳入本研究。基线时,34 例(25.4%)患者为合并 EMD(EMD+ 组),25 例(18.7%)患者合并 PSD 但无 EMD(PSD-only 组),75 例(56.0%)患者不合并 EMD(BM-only 组)。年龄、性别、CAR-T 类别、ISS 分期、细胞遗传学风险和移植史在 EMD+ 组、PSD-only 组和 BM-only 组患者之间的基线特征较为均衡(表 1)。
表 1. 基线人口统计学和临床特征
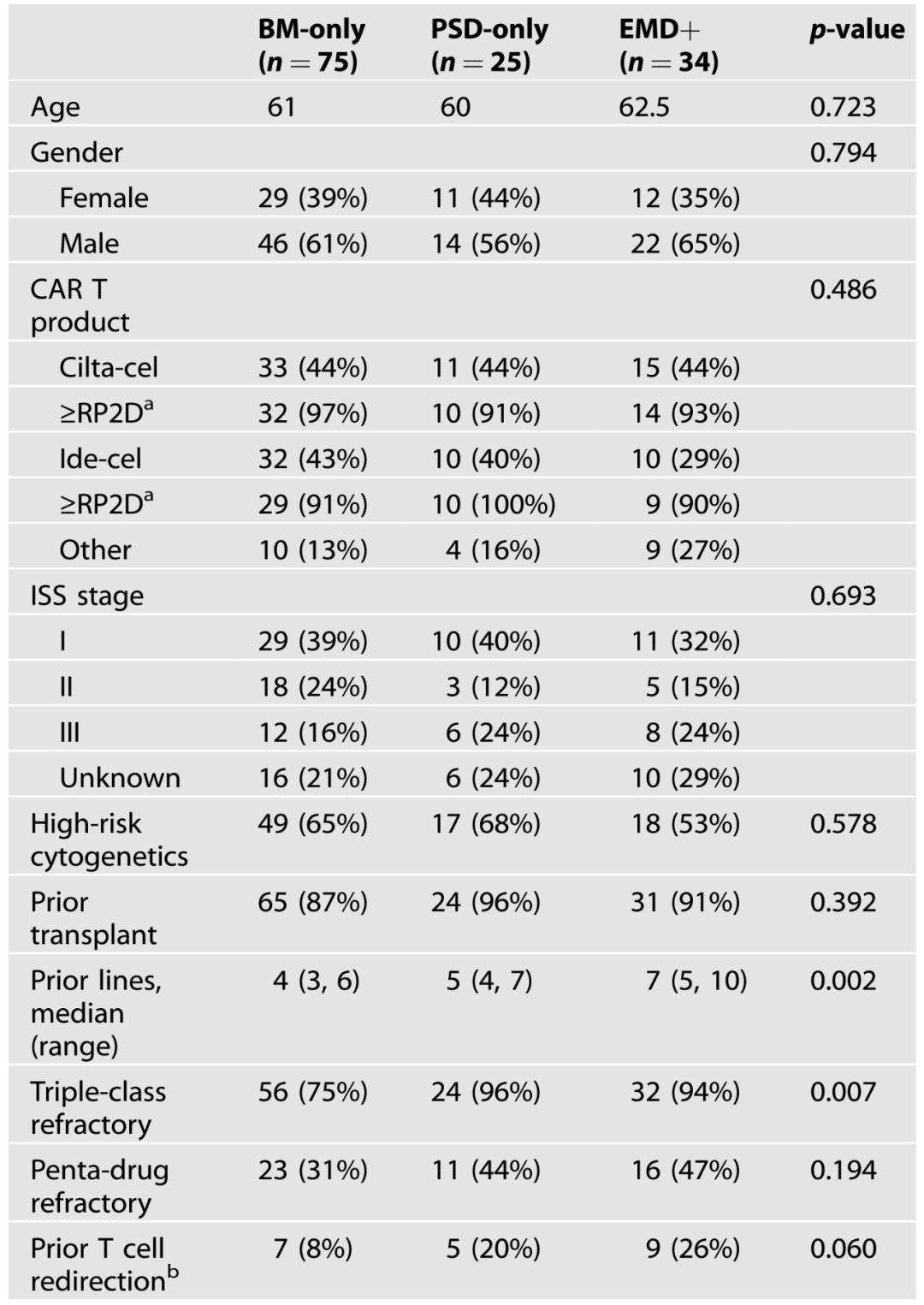
BM-only 组的患者中位 PFS 为 24.2 个月,而 PSD-only 组的患者中位 PFS 为 21.4 个月。与 BM-only 组相比,EMD+ 组的患者中位 PFS 显著缩短,为 9.0 个月。BM-only 组和 PSD-only 组的患者中位 OS 未达到,而 EMD+ 组的患者中位 OS 为 24.0 个月;BM-only 组、PSD-only 组和 EMD+ 组的患者 12 个月 PFS 率分别为 91%、92% 和 71%,而 24 个月 OS 率分别为 80%、83% 和 52%。CAR-T 细胞治疗后,BM-only 组和 PSD-only 组的患者 OS 无显著差异,而 EMD + 组的患者 OS 显著缩短(图 1)。
图 1. BM-only 组、PSD-only 组 和 EMD +组患者的临床结局
在 EMD + 组的患者中,SPD < 25 cm2(n = 26)人群的 ORR 为 81.0%,完全缓解(CR)率为 66.7%,SPD 25-50 cm2(n = 6)人群的 ORR 为 83.3%,CR 率为 50%,SPD > 50 cm2(n = 7)人群的 ORR 为 57.1% ,CR 率为 0%。SPD < 25 cm2、25-50 cm2、> 50 cm2 的人群的中位 PFS 分别为 9.03 个月,5.28 个月和 3.32 个月,中位 OS 分别为 24.03 个月、未达到(NE)、15.69 个月(图 2)。
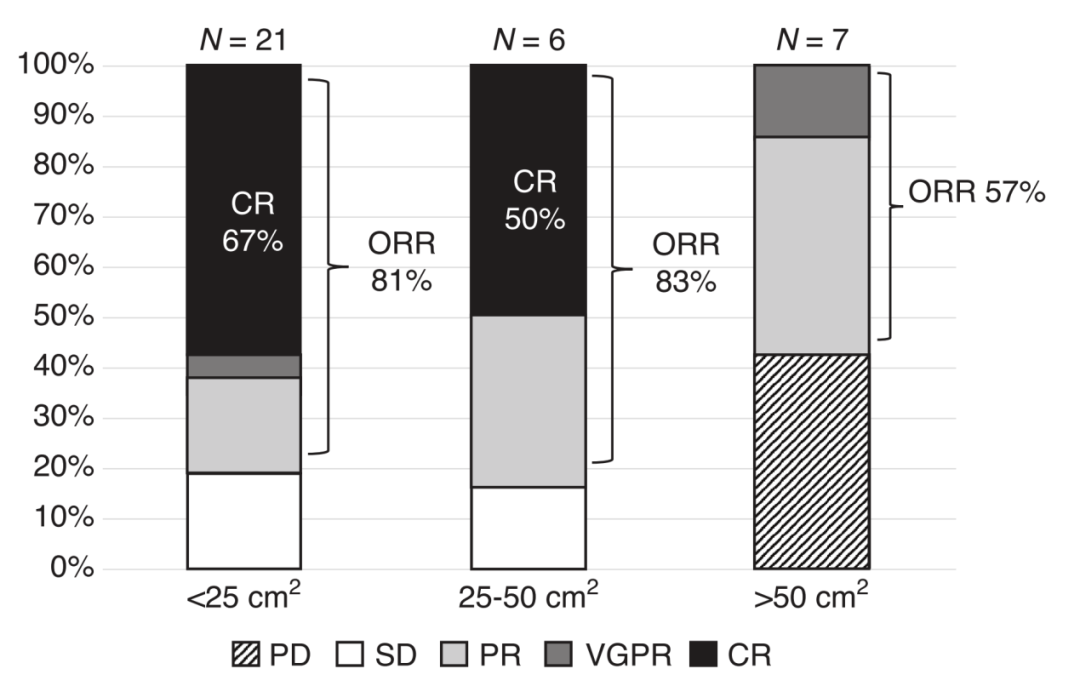
图 2. EMD + 组患者基于不同疾病负荷分层的治疗反应
从病灶部位来看,合并器官型 EMD 患者的中位 PFS 为 3.32 个月,而合并软组织型 EMD 患者的中位 PFS 为 9.03 个月;中位 OS 分别为 7.39 个月和 26.00 个月(图 3)。
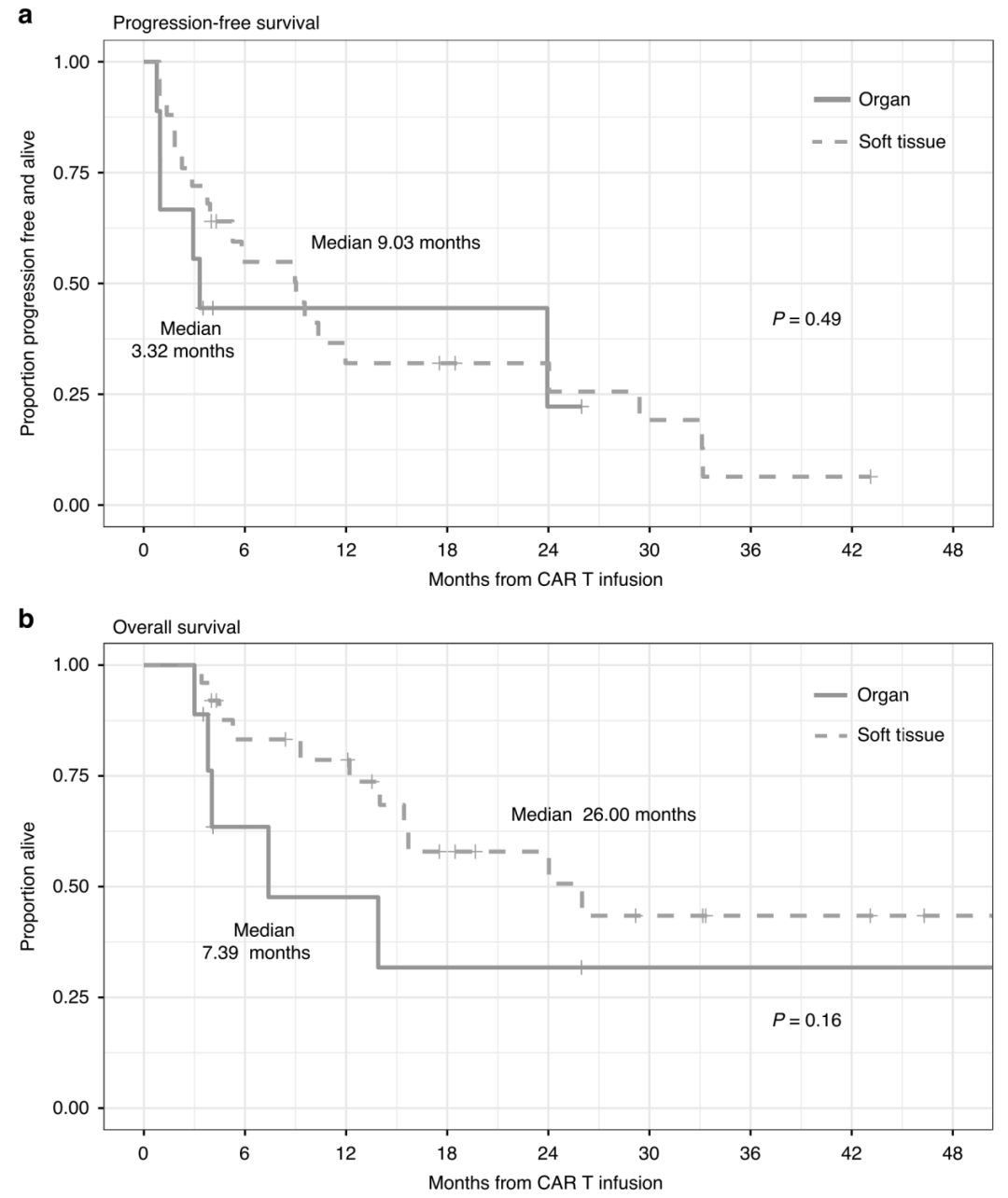
图 3. 基于不同髓外病变部位进行分层的结果分析
69 例患者在治疗后复发,其中 34 例患者在疾病进展时合并 EMD(21 例患者在基线时为 EMD+,13 名患者基线时不合并 EMD,但疾病进展时新发 EMD)(图 4)。在 21 例 EMD + 组的复发患者中,7 例基线时合并 EMD 的患者在复发时仅原有部位有 EMD,7 例患者仅新发部位合并 EMD。7 例在原有部位和新发部位均合并 EMD。此外,研究者对 6 例髓外浆细胞瘤(EMD+)进行了活检,并用免疫组织化学方法(IHC)进行 B 细胞成熟抗原(BCMA)染色。在 6 例患者中,有 5 例患者标本中 50% 以上细胞存在中度或较强的染色。
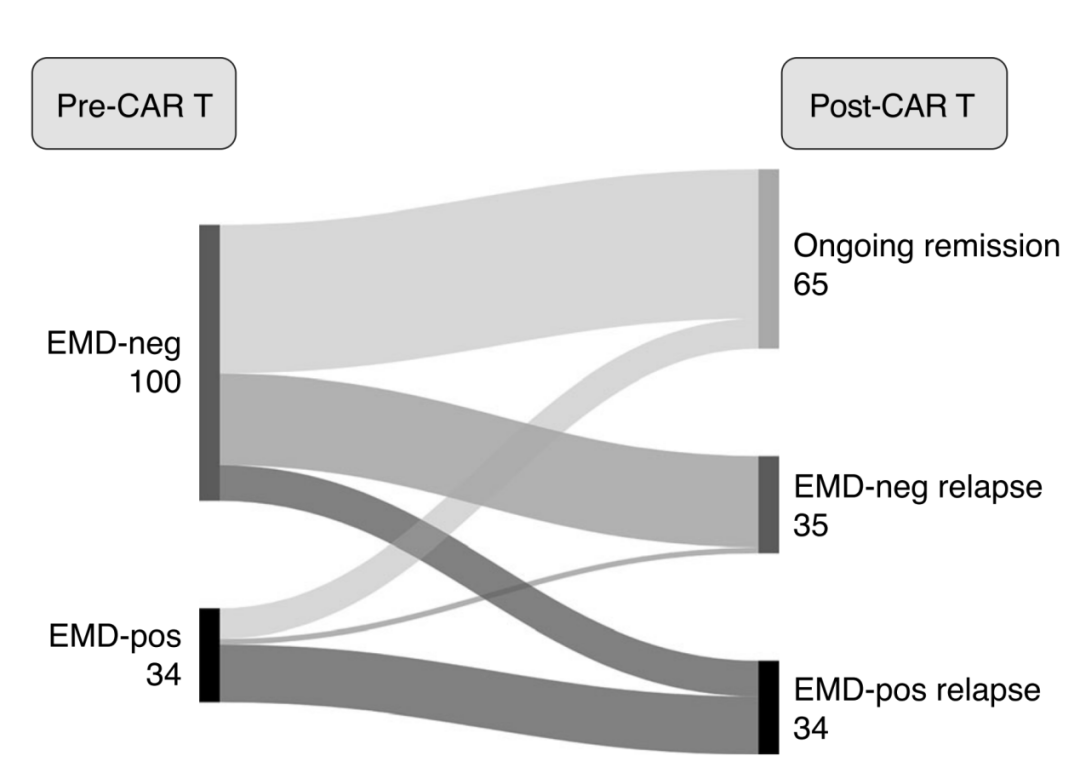
图 4. CAD-T 治疗前后 EMD 的 Sankey 图
通过分别评估骨旁病变(PSD)和非相邻的髓外病变(EMD),研究者发现 CAR-T 细胞治疗似乎可以减轻 PSD 相关的负性预后影响,合并 PSD 的患者和无软组织浆细胞瘤患者之间的 PFS 或 OS 没有差异。相反,EMD 仍然是一个明显的负性预后因素。合并 EMD 的患者的疾病进展/死亡风险几乎时不合并浆细胞瘤患者的 2 倍,死亡风险几乎是其 4 倍。这一结论与近期一项针对 152 例接受标准 CAR-T 细胞治疗的 RRMM 患者开展的研究结果一致,该研究发现合并 PSD 和不合并随外浸润的患者 PFS 和 OS 相似,而合并 EMD 的患者 PFS 和 OS 更差 [13]。
研究者基于髓外病灶的负荷大小开展了 EMD+ 人群的预后分层分析,结果显示,在接受 CAR-T 细胞治疗后,SPD<50 cm2(SPD < 25 cm2 和 25 - 50 cm2)的 EMD+ 患者中,三分之二的患者体内 EMD 完全清除。相反,髓外病变负荷较高的患者(SPD ≥ 50 cm2)的缓解率较低,未见完全缓解。研究者认为,在 CAR-T 细胞输注之前,针对 EMD 病灶负荷较高的患者先采用有效的桥接治疗或可提高深度缓解率。
在当前骨髓瘤诊疗现状中,针对 CAR-T 细胞疗法的关注点已经从「是否使用」转移到了「使用的时机和管理的策略」。
结合本研究的主要结果,研究者认为,在 RRMM 患者中,与接受既往标准治疗相比,合并 PSD 的患者可能会从 CAR-T 细胞治疗中获益更多。然而,合并 EMD 的患者却表现出针对 CAR-T 细胞疗法等创新型治疗方案的显著抵抗性(治疗效果相对不敏感)。
综上,该研究证实,合并 EMD 可能是造成 CAR-T 细胞治疗后不良预后结局的重要因素,而与 PSD 无关。
然而,本研究存在一些局限性:包括回顾性研究性质、EMD+ 组的样本量较小,以及未能深入探索 EMD+ 人群针对 CAR-T 细胞的治疗抵抗性的原因。
未来,开展进一步探索 EMD 的免疫结构或可为本研究结论提供坚实的生物学基础,并有望揭示免疫逃逸相关的潜在治疗策略。未来的研究方向应包括:开发更为有效的根治 EMD 的治疗策略、优化 CAR-T 细胞疗法联合治疗(例如联合放疗、药物系统治疗等)。
编辑 | Bree(jiamei sun)
投稿 | sunjiamei@dxy.cn
排版 | 姣姣
题图 | 站酷海洛
